Zellteilung: Wie das Zentromer seinen Platz findet
05.09.2024
Forschende haben den Mechanismus aufgeklärt, mit dem die Integrität des Zentromers bewahrt wird - ein Schlüsselfaktor der Zellteilung.
05.09.2024
Forschende haben den Mechanismus aufgeklärt, mit dem die Integrität des Zentromers bewahrt wird - ein Schlüsselfaktor der Zellteilung.

Prof. Jeyaprakash Arulanandam | © LMU
Das Zentromer ist ein spezieller Bereich der DNA, an dem der sogenannte Spindelapparat ansetzt, um identische Kopien des genetischen Materials der Zelle in neu gebildete Zellen aufzuteilen. Forschende der LMU und der Universität Edinburgh unter der Leitung von Professor Jeyaprakash Arulanandam haben nun gezeigt, dass ein Protein namens PLK1 einen Prozess anstößt, durch den Schlüsselproteine des Zentromers während der Zellteilung zur richtigen Zeit an den richtigen Ort gelangen. So wird sichergestellt, dass jede neue Zelle ein Zentromer an der richtigen Stelle hat. Diese Entdeckung, über die die Wissenschaftlerinnen und Wissenschaftler im Fachmagazin Science berichten, ermöglicht neue Einblicke in einen der grundlegendsten Prozesse des Lebens.
„Im menschlichen Körper teilen sich jeden Tag etwa zwei Billionen Zellen. Fehler bei der Trennung der Chromosomen können katastrophale Folgen haben. Wenn die Zentromere fehlen oder sich an der falschen Stelle befinden, wird die genetische Information nicht korrekt verteilt. Bei Erwachsenen kann dies zu vielen Krankheiten, einschließlich Krebs, führen, während es in den frühesten Stadien des Lebens Fehlbildungen verursachen kann“, sagt Arulanandam.
Die Zellteilungsmaschinerie erkennt die Zentromere daran, dass dort sogenannte CENP-A Proteine angereichert sind. Bei jeder Zellteilung müssen die Vorräte dieses Proteins an den Zentromeren wieder aufgefüllt werden. Die genauen molekularen Vorgänge, die es dem Zentromer ermöglichen, seine Identität und Lage über eine große Anzahl von Zellteilungen hinweg zu bewahren, sind seit Jahren Gegenstand intensiver Forschung.
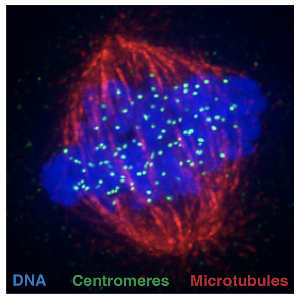
Die Mikrotubuli des Spindelapparats heften sich an Zentromere, um die DNA zu trennen. | © Alba Abad Fernandez
Eine andere Gruppe konnte bereits zeigen, dass das Protein PLK1 einer der molekularen „Hauptschalter“ ist, die steuern, wann die Auffüllung des CENP-A erfolgt. Sein Wirkungsmechanismus blieb allerdings ein Rätsel. In ihrer neuen Studie setzten die Forschenden biophysikalische, biochemische, strukturelle und zellbiologische Techniken ein, um die Wirkungsweise von PLK1 zu analysieren.
Ihre Ergebnisse zeigten, dass PLK1 eine chemische Modifikation, eine sogenannte Phosphorylierung, der Proteine Mis18α and Mis18BP1 erkennt, die zum sogenannten Mis-18-Komplex gehören, und dadurch mit dem Komplex interagiert. Frühere Forschungen, einschließlich der Arbeiten von Arulanandams Team, hatten bereits gezeigt, dass dieser Komplex eine wichtige Rolle bei der Auffüllung der CENP-A-Spiegel spielt. Durch die Interaktion mit PLK1 werden weitere Phosphorylierungen angestoßen, durch die der Komplex aktiviert wird.
„Wir konnten zeigen, dass die PLK1-vermittelte Aktivierung des Mis18-Komplexes die Bindung des Komplexes an ein anderes Protein, bekannt als HJURP, erleichtert, das dann phosphoryliert wird und für das Laden von CENP-A auf die Zentromere verantwortlich ist“, sagt Paula Sotelo-Parrilla, Forscherin in Arulanandams Münchner Team und eine der Hauptautorinnen der Arbeit. Der Mis18-Komplex kontrolliert auf diese Weise, wann HJURP an das Zentromer bindet und stellt sicher, dass CENP-A an der richtigen Stelle und zum richtigen Zeitpunkt während der Zellteilung geladen wird.
„PLK1 setzt einen molekularen Prozess in Gang, der einem Staffellauf ähnelt und bestimmt, wie und wann Schlüsselproteine interagieren. Es sorgt dafür, dass die CENP-A-Konzentration nach jeder Zellteilung wiederhergestellt wird, um die Integrität des Zentromers zu erhalten“, erklärt Pragya Parashara, ebenfalls eine Hauptautorin der Studie. „Dies ist einer der wichtigsten Schutzmechanismen der Zelle und entscheidend für die korrekte Weitergabe des genetischen Materials über unzählige Zellgenerationen hinweg - was für die Entstehung und Erhaltung des Lebens unerlässlich ist.“
P. Parashara et al.: PLK1-Mediated Phosphorylation Cascade Activates Mis18 Complex to Ensure Centromere Inheritance. Science 2024